PCR的基本原理和操作步驟
普通PCR概述
聚合酶鏈?zhǔn)椒磻?yīng)(Polymerase Chain Reaction)岗仑,簡稱PCR匹耕,是一種分子生物學(xué)技術(shù),用于放大特定的DNA片段荠雕∥绕洌可看作生物體外的特殊DNA復(fù)制。DNA聚合酶(DNA polymerase I)zui早于1955年發(fā)現(xiàn)舞虱,而較具有實驗價值及實用性的Klenow fragment of E. Coli 則是于70年代的初期由Dr. H. Klenow 所發(fā)現(xiàn)欢际,但由于此酶不耐高溫,高溫能使之變性, 因此不符合使用高溫變性的聚合酶鏈?zhǔn)椒磻?yīng)》担現(xiàn)今所使用的酶(簡稱Taq polymerase), 則是于1976年從溫泉中的細菌(Thermus aquaticus)分離出來的损趋。它的特性就在于能耐高溫,是一個很理想的酶,但它被廣泛運用則于80年代之后浑槽。
PCRzui初的原始雛形概念是類似基因修復(fù)復(fù)制蒋失,它是于1971年由 Dr. Kjell Kleppe 提出。他發(fā)表了個單純且短暫性基因復(fù)制(類似PCR前兩個周期反應(yīng))的實驗桐玻。而現(xiàn)今所發(fā)展出來的PCR則于1983由 Dr. Kary B. Mullis發(fā)展出的篙挽,Dr. Mullis當(dāng)年服務(wù)于PE公司,因此PE公司在PCR界有著特殊的地位镊靴。Dr. Mullis 并于1985年與Saiki 等人正式發(fā)表了篇相關(guān)的論文铣卡。此后,PCR的運用一日千里偏竟,相關(guān)的論文發(fā)表質(zhì)量可以說是令眾多其它研究方法難望其項背煮落。隨后PCR技術(shù)在生物科研和臨床應(yīng)用中得以廣泛應(yīng)用,成為分子生物學(xué)研究的zui重要技術(shù)踊谋。Mullis也因此獲得了1993年諾貝爾化學(xué)獎蝉仇。
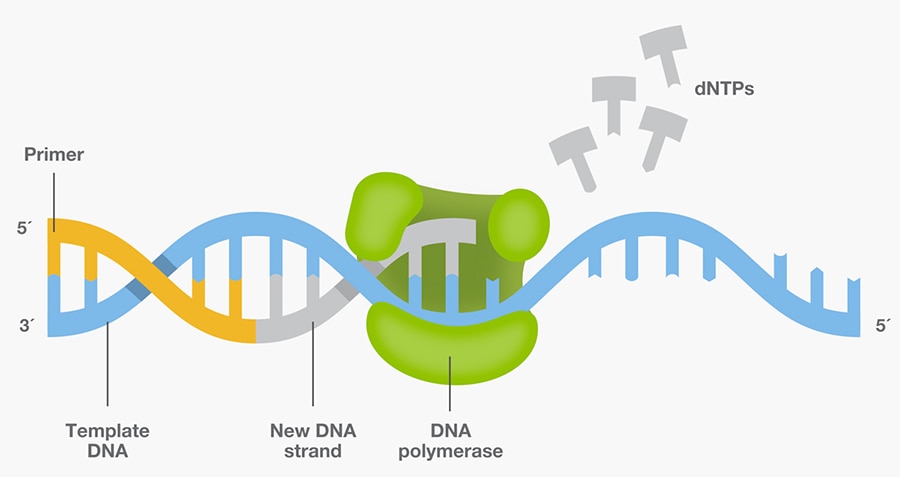
2 PCR原理
PCR技術(shù)的基本原理類似于DNA的天然復(fù)制過程,其特異性依賴于與靶序列兩端互補的寡核苷酸引物殖蚕。PCR由變性--退火--延伸三個基本反應(yīng)步驟構(gòu)成:
①模板DNA的變性:模板DNA經(jīng)加熱至93℃左右一定時間后轿衔,使模板DNA雙鏈或經(jīng)PCR擴增形成的雙鏈DNA解離,使之成為單鏈睦疫,以便它與引物結(jié)合害驹,為下輪反應(yīng)作準(zhǔn)備;
②模板DNA與引物的退火(復(fù)性):模板DNA經(jīng)加熱變性成單鏈后蛤育,溫度降至55℃左右裙秋,引物與模板DNA單鏈的互補序列配對結(jié)合;
③引物的延伸:DNA模板--引物結(jié)合物在TaqDNA聚合酶的作用下缨伊,以dNTP為反應(yīng)原料摘刑,靶序列為模板,按堿基互補配對與半保留復(fù)制原理刻坊,合成一條新的與模板DNA 鏈互補的半保留復(fù)制鏈枷恕,重復(fù)循環(huán)變性--退火--延伸三過程就可獲得更多的“半保留復(fù)制鏈”,而且這種新鏈又可成為下次循環(huán)的模板谭胚。每完成一個循環(huán)需2~4分鐘徐块,2~3小時就能將待擴目的基因擴增放大幾百萬倍。
3 PCR反應(yīng)體系與反應(yīng)條件
3.1標(biāo)準(zhǔn)的PCR反應(yīng)體系
| 10×擴增緩沖液 | 10μl |
| 4種dNTP混合物 | 200μl |
| 引物 | 10~100μl |
| 模板DNA | 0.1~2μg |
| Taq DNA聚合酶 | 2.5 μl |
| Mg2+ | 1.5mmol/L |
| 加雙或三蒸水 | 100 μl |
3.2 PCR反應(yīng)五要素
參加PCR反應(yīng)的物質(zhì)主要有五種即引物(PCR引物為DNA片段灾而,細胞內(nèi)DNA復(fù)制的引物為一段RNA鏈)胡控、酶、dNTP旁趟、模板和緩沖液(其中需要Mg2+)昼激。[PCR步驟]
標(biāo)準(zhǔn)的PCR過程分為三步:
1.DNA變性(90℃-96℃):雙鏈DNA模板在熱作用下, 氫鍵斷裂,形成單鏈DNA
2.退火(25℃-65℃):系統(tǒng)溫度降低橙困,引物與DNA模板結(jié)合瞧掺,形成局部雙鏈。
3.延伸(70℃-75℃):在Taq酶(在72℃左右凡傅,活性zui佳)的作用下辟狈,以dNTP為原料,從引物的5′端→3′端延伸夏跷,合成與模板互補的DNA鏈哼转。
每一循環(huán)經(jīng)過變性、退火和延伸槽华,DNA含量即增加一倍∈筒荆現(xiàn)在有些PCR因為擴增區(qū)很短,即使Taq酶活性不是zui佳也能在很短的時間內(nèi)復(fù)制完成硼莽,因此可以改為兩步法,即退火和延伸同時在60℃-65℃間進行煮纵,以減少一次升降溫過程懂鸵,提高了反應(yīng)速度。
4 PCR反應(yīng)特點
4.1特異性強 PCR反應(yīng)的特異性決定因素為:
①引物與模板DNA特異正確的結(jié)合行疏;
②堿基配對原則匆光;
③Taq DNA聚合酶合成反應(yīng)的忠實性;
④靶基因的特異性與保守性酿联。
其中引物與模板的正確結(jié)合是關(guān)鍵终息。引物與模板的結(jié)合及引物鏈的延伸是遵循堿基配對原則的。聚合酶合成反應(yīng)的忠實性及Taq DNA聚合酶耐高溫性贞让,使反應(yīng)中模板與引物的結(jié)合(復(fù)性)可以在較高的溫度下進行周崭,結(jié)合的特異性大大增加,被擴增的靶基因片段也就能保持很高的正確度喳张。再通過選擇特異性和保守性高的靶基因區(qū)续镇,其特異性程度就更高。
4.2 靈敏度高
PCR產(chǎn)物的生成量是以指數(shù)方式增加的销部,能將皮克(pg=10-12)量級的起始待測模板擴增到微克(μg=-6)水平摸航。能從100萬個細胞中檢出一個靶細胞;在病毒的檢測中舅桩,PCR的靈敏度可達3個RFU(空斑形成單位)酱虎;在細菌學(xué)中zui小檢出率為3個細菌。
4.3簡便擂涛、快速
PCR反應(yīng)用耐高溫的Taq DNA聚合酶读串,一次性地將反應(yīng)液加好后,即在DNA擴增液和水浴鍋上進行變性-退火-延伸反應(yīng),一般在2~4 小時完成擴增反應(yīng)爹土。擴增產(chǎn)物一般用電泳分析甥雕,不一定要用同位素,無放射性污染胀茵、易推廣社露。
4.4 對標(biāo)本的純度要求低
不需要分離病毒或細菌及培養(yǎng)細胞,DNA 粗制品及RNA均可作為擴增模板琼娘∏偷埽可直接用臨床標(biāo)本如血液、體腔液脱拼、洗嗽液瞒瘸、毛發(fā)、細胞熄浓、活組織等DNA擴增檢測情臭。
PCR常見問題
5.1假陰性,不出現(xiàn)擴增條帶
PCR反應(yīng)的關(guān)鍵環(huán)節(jié)有:
①模板核酸的制備赌蔑,
②引物的質(zhì)量與特異性俯在,
③酶的質(zhì)量及,
④PCR循環(huán)條件娃惯。
尋找原因亦應(yīng)針對上述環(huán)節(jié)進行分析研究跷乐。
模板:
①模板中含有雜蛋白質(zhì),
②模板中含有Taq酶抑制劑趾浅,
③模板中蛋白質(zhì)沒有消 化除凈愕提,特別是染色體中的組蛋白,
④在提取制備模板時丟失過多皿哨,或吸入酚浅侨。
⑤模 板核酸變性不徹底。在酶和引物質(zhì)量好時证膨,不出現(xiàn)擴增帶仗颈,極有可能是標(biāo)本的消化處 理,模板核酸提取過程出了毛病椎例,因而要配制有效而穩(wěn)定的消化處理液挨决,其程序亦應(yīng) 固定不宜隨意更改。
酶失活:需更換新酶订歪,或新舊兩種酶同時使用脖祈,以分析是否因酶的活性喪失或不夠而導(dǎo)致假陰性。需注意的是有時忘加Taq酶或溴乙錠刷晋。
引物:引物質(zhì)量盖高、引物的濃度慎陵、兩條引物的濃度是否對稱,是PCR失敗或擴增條帶不理想喻奥、容易彌散的常見原因席纽。有些批號的引物合成質(zhì)量有問題,兩條引物一條濃度 高撞蚕,一條濃度低润梯,造成低效率的不對稱擴增,對策為:
①選定一個好的引物合成單 位甥厦。
②引物的濃度不僅要看OD值纺铭,更要注重引物原液做瓊脂糖凝膠電泳,一定要有引物條帶出現(xiàn)刀疙,而且兩引物帶的亮度應(yīng)大體一致舶赔,如一條引物有條帶,一條引物無條帶谦秧,此時做PCR有可能失敗竟纳,應(yīng)和引物合成單位協(xié)商解決。如一條引物亮度高疚鲤,一條亮度低锥累,在稀釋引物時要平衡其濃度。
③引物應(yīng)高濃度小量分裝保存石咬,防止多次凍融或長期放冰箱冷藏部分,導(dǎo)致引物變質(zhì)降解失效卖哎。
④引物設(shè)計不合理鬼悠,如引物長度不夠,引物之間形成二聚體等亏娜。
Mg2+濃度:Mg2+離子濃度對PCR擴增效率影響很大焕窝,濃度過高可降低PCR擴增的特異性,濃度過低則影響PCR擴增產(chǎn)量甚至使PCR擴增失敗而不出擴增條帶维贺。
反應(yīng)體積的改變:通常進行PCR擴增采用的體積為20ul它掂、30ul、50ul溯泣∨扒铮或100ul,應(yīng)用多大體積進行PCR擴增垃沦,是根據(jù)科研和臨床檢測不同目的而設(shè)定客给,在做小體積如20ul 后,再做大體積時肢簿,一定要模索條件靶剑,否則容易失敗蜻拨。
物理原因:變性對PCR擴增來說相當(dāng)重要,如變性溫度低桩引,變性時間短缎讼,極有可能出現(xiàn)假陰性;退火溫度過低,可致非特異性擴增而降低特異性擴增效率退火溫度過高影響引物與模板的結(jié)合而降低PCR擴增效率坑匠。有時還有必要用標(biāo)準(zhǔn)的溫度計血崭,檢測一下擴增儀或水溶鍋內(nèi)的變性、退火和延伸溫度笛辟,這也是PCR失敗的原因之一功氨。
靶序列變異:如靶序列發(fā)生突變或缺失,影響引物與模板特異性結(jié)合手幢,或因靶序列某 段缺失使引物與模板失去互補序列捷凄,其PCR擴增是不會成功的。
5.2 假陽性
出現(xiàn)的PCR擴增條帶與目的靶序列條帶一致围来,有時其條帶更整齊跺涤,亮度更高。
引物設(shè)計不合適:選擇的擴增序列與非目的擴增序列有同源性监透,因而在進行PCR擴增時桶错,擴增出的PCR產(chǎn)物為非目的性的序列。靶序列太短或引物太短胀蛮,容易出現(xiàn)假陽性院刁。需重新設(shè)計引物。
靶序列或擴增產(chǎn)物的交叉污染:這種污染有兩種原因:一是整個基因組或大片段的交叉污染粪狼,導(dǎo)致假陽性退腥。這種假陽性可用以下方法解決:操作時應(yīng)小心輕柔,防止將靶序列吸入加樣槍內(nèi)或濺出離心管外再榄。除酶及不能耐高溫的物質(zhì)外狡刘,試劑或器材均應(yīng)高壓。所用離心管及樣進槍頭等均應(yīng)一次性使用困鸥。必要時嗅蔬,在加標(biāo)本前,反應(yīng)管和試劑用紫外線照射疾就,以破壞存在的核酸澜术。二是空氣中的小片段核酸污染,這些小片段比靶序列短猬腰,但有一定的同源性瘪板。可互相拼接漆诽,與引物互補后侮攀,可擴增出PCR產(chǎn)物锣枝,而導(dǎo)致假陽性的產(chǎn)生,可用巢式PCR方法來減輕或消除兰英。
5.3 出現(xiàn)非特異性擴增帶
PCR擴增后出現(xiàn)的條帶與預(yù)計的大小不一致撇叁,或大或小,或者同時出現(xiàn)特異性擴增帶 與非特異性擴增帶畦贸。非特異性條帶的出現(xiàn)陨闹,其原因:一是引物與靶序列不完全互補、 或引物聚合形成二聚體薄坏。二是Mg2+離子濃度過高趋厉、退火溫度過低,及PCR循環(huán)次數(shù) 過多有關(guān)胶坠。其次是酶的質(zhì)和量君账,往往一些來源的酶易出現(xiàn)非特異條帶而另一來源的酶 則不出現(xiàn),酶量過多有時也會出現(xiàn)非特異性擴增沈善。其對策有:必要時重新設(shè)計引 物乡数。減低酶量或調(diào)換另一來源的酶。降低引物量闻牡,適當(dāng)增加模板量净赴,減少循環(huán)次 數(shù)。適當(dāng)提高退火溫度或采用二溫度點法(93℃變性罩润,65℃左右退火與延伸)玖翅。
5.4出現(xiàn)片狀拖帶或涂抹帶
PCR擴增有時出現(xiàn)涂抹帶或片狀帶或地毯樣帶。其原因往往由于酶量過多或酶的質(zhì)量 差割以,dNTP濃度過高金度,Mg2+濃度過高,退火溫度過低拳球,循環(huán)次數(shù)過多引起审姓。其對策有:減少酶量珍特,或調(diào)換另一來源的酶祝峻。②減少dNTP的濃度。適當(dāng)降低Mg2+濃 度扎筒。增加模板量莱找,減少循環(huán)次數(shù)。








 添加微信咨詢奥溺!
添加微信咨詢奥溺!